
Apoyar la innovación en medicamentos de nueva generación
Por Jack Ellis, investigador asociado, Geneva Network*
*Jack Ellis trabaja actualmente como periodista independiente, tras haber sido editor para la región de Asia y el Pacífico de la revista Intellectual Asset Management , que trata cuestiones relacionadas con la propiedad intelectual y el mercado de servicios jurídicos.
En medicina, la supremacía de los medicamentos elaborados a base de moléculas pequeñas está llegando a su fin. En el futuro, cada vez más tratamientos serán biológicos –medicamentos complejos con estructuras moleculares mucho más grandes fabricados en el interior de estructuras vivas como células animales o bacterias–.
La nueva era de la biotecnología promete revolucionar la manera en que los médicos abordan el tratamiento de las enfermedades y ofrece esperanza a pacientes que padecen afecciones para las cuales no hay actualmente tratamiento. Es de esperar que los avances en ámbitos como la terapia génica, el desarrollo de vacunas más seguras, la medicina de precisión y la mejora de los diagnósticos beneficien a millones de personas.
A pesar del potencial transformador de la biotecnología médica, la investigación y desarrollo (I+D) en este tipo de actividades sigue concentrándose en un puñado de países. Los Estados Unidos de América son, de lejos, el líder mundial en producción biotecnológica, seguidos por el Reino Unido, Suiza, Alemania, Francia y el Japón. Si bien algunos mercados emergentes como China cuentan con incipientes industrias biotecnológicas, la distribución geográfica de las actividades de I+D en biotecnología dista de ser homogénea a nivel mundial.
Los países que cuentan con una industria biotecnológica fuerte se han dotado de robustos marcos regulatorios, infraestructuras de I+D apropiadas y sistemas de propiedad intelectual (P.I.) eficaces, a fin de permitir la movilización de las cuantiosas inversiones que se precisan para financiar los proyectos de biotecnología, que conllevan un nivel de riesgo elevado.
Para fomentar la innovación en medicamentos biológicos, el derecho de P.I. más importante no son las patentes sino la protección de los datos de pruebas (datos facilitados a los organismos reguladores) pues, durante un tiempo este tipo de protección impide que los competidores hagan uso de los datos obtenidos en ensayos clínicos por el creador del medicamento. Todos los países punteros en biotecnología cuentan con normas de obligado cumplimiento para proteger dichos datos.
¿Qué es la protección de datos de pruebas?
Los organismos reguladores exigen que se proporcionen datos de los ensayos clínicos y preclínicos para poder aprobar una tecnología médica y certificar que es segura y eficaz para el consumidor antes de su comercialización. Los ensayos clínicos son altamente meticulosos y onerosos, y contribuyen sustancialmente a los costos de desarrollar un nuevo medicamento. Según las estimaciones, esta contribución se situaría entre los USD 1.200 millones de dólares EE.UU (Oficina de Economía de la Salud del Reino Unido) y los 2.600 millones de dólares (Universidad de Tufts, Estados Unidos).
En la mayoría de sectores, las empresas pueden proteger los datos comercialmente sensibles gracias a la legislación sobre secretos comerciales; en el caso de las compañías de biotecnología, según nos cuenta Susan Finston –cofundadora de la emergente empresa india de medicamentos biológicos Amrita Therapeutics–, la obligación de transmitir datos a los organismos reguladores las posiciona en una situación de desventaja.
“Las recetas de una empresa ordinaria de alimentos y bebidas pueden ser secretos comerciales y mantenerse así perpetuamente. Pero si eres un innovador en biofarma, tienes que mostrar tu “libro de cocina” a los reguladores”, señala la Sr. Finston.
La protección de datos de pruebas es fundamental para los innovadores en biofarma, pues garantiza que los competidores no puedan conseguir la aprobación del organismo regulador y lanzar sus productos al mercado a expensas de los datos de pruebas del innovador antes de que este haya tenido la oportunidad de recuperar los costos en que ha incurrido para recabar esos datos.
“En industrias como la biofarma o la agrotecnología, existen serias razones de interés público para que los reguladores tengan acceso a los datos de pruebas de los innovadores”, señala la Sra. Finston, subrayando la importancia de la exclusividad de los datos de los innovadores. “Los acuerdos en materia de protección de datos de pruebas permiten que los reguladores accedan a esos datos con la condición de no divulgarlos”.
El panorama internacional
A nivel internacional, la protección de datos de pruebas se rige por el Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio (Acuerdo sobre los ADPIC) de la Organización Mundial del Comercio (OMC). En el párrafo 3 del artículo 39 del Acuerdo se establece que los Miembros de la OMC protegerán los datos de pruebas facilitados a los organismos reguladores contra todo uso comercial desleal. Además, los Miembros protegerán esos datos contra toda divulgación, excepto cuando sea necesario para proteger al público, o salvo que se adopten medidas para garantizar la protección de los datos contra todo uso comercial desleal. Desde el 1 de enero de 2000, todos los Miembros de la OMC, salvo los países menos adelantados, están obligados a proteger los derechos de propiedad de los datos que se facilitan cuando se registran nuevos medicamentos; no obstante, muchos países todavía no cumplen ese requisito.
Ensayos clínicos y medicamentos biosimilares
Una razón importante por la que los reguladores quieren tener acceso a los datos de pruebas de los innovadores es poder evaluar las versiones posteriores de medicamentos patentados que hayan fabricado empresas competidoras. Al igual que los creadores de productos farmacéuticos basados en moléculas pequeñas se enfrentan, pasado un tiempo, a la competencia de los fabricantes de medicamentos genéricos, los innovadores en el campo de los medicamentos biológicos deben hacer frente a la competencia de fabricantes de productos biosimilares, pero con una diferencia importante.
La estructura de los medicamentos biológicos es mucho más compleja que la de los medicamentos “tradicionales”, sintetizados químicamente, y esto hace que resulte imposible replicar exactamente un medicamento biológico original. Los mejores competidores pueden lograr un medicamento biosimilar –un producto de estructura y efectos parecidos–. Para que una compañía consiga del organismo regulador la autorización de fabricar un medicamento biosimilar, esta debe demostrar mediante ensayos clínicos que su medicamento es comparable al producto original en eficacia, calidad y seguridad. Las autoridades reguladoras solo pueden conceder esa aprobación si tienen acceso a los datos de pruebas del innovador.
¿Por qué no basta con las patentes?
Según afirma la Dra. Kristina Lybecker, profesora asociada en Colorado College y especialista en derechos de P.I. en la industria farmacéutica, la protección de datos de pruebas aporta a los innovadores cierto grado de seguridad, algo que resulta muy necesario para su actividad.
“La protección mediante patentes y la exclusividad de los datos son formas complementarias de protección de la PI, y ambas sirven para incentivar las enormes inversiones necesarias para el desarrollo de medicamentos biológicos”, apunta.
Los críticos de esta postura argumentan que la protección de datos de pruebas es una medida excesiva, pues amplía de facto la protección tras la fecha de expiración de la patente y retrasa el desarrollo de productos biosimilares más económicos, lo cual perjudica a los proveedores de servicios de salud y a los pacientes. A su vez, los partidarios de este tipo de protección alegan que resulta esencial para garantizar que se siga invirtiendo en innovación biotecnológica.
Jack Lasersohn, socio de Vertical Group –una firma de capital riesgo con sede en los Estados Unidos centrada en la inversión en industrias relacionadas con la salud– explica que “la legislación en materia de patentes protege hasta cierto punto, pero no completamente” y afirma que “resulta más difícil proteger un medicamento biológico de un producto biosimilar que proteger una molécula pequeña de un genérico que es químicamente idéntico. Si permitimos que se aprueben medicamentos similares utilizando los mismos datos, es obvio que la legislación en materia de patentes no aporta el mismo grado de protección”.
En 2010, gracias al enérgico apoyo de la National Venture Capital Association (asociación nacional de inversores de capital riesgo), se aprobó en los Estados Unidos de América la Ley de Competencia de Precios e Innovación de Productos Biológicos, que contempla un período de 12 años de exclusividad de los datos de pruebas para los productos biológicos nuevos desde la fecha en que hayan recibido la primera aprobación por parte de regulador estadounidense.
El Sr. Lasersohn acoge con agrado este avance, pues opina que “los derechos de propiedad, entre ellos las patentes y la protección de datos de pruebas, son esenciales para la existencia de inversión. Nadie quiere invertir en algo de lo que no se posee una parte. Las patentes y la protección de datos de pruebas proporcionan una forma de propiedad y, por consiguiente, hacen posible la inversión”.
“Cuando un inversor de capital riesgo estudia realizar una inversión, necesita justificarla sobre la base de la tasa de rendimiento y de la duración de ese beneficio económico. El rendimiento obtenido varía directamente en función de la durabilidad de la inversión; en otras palabras: durante cuánto tiempo va a generar ingresos y beneficios. Cuanto menor sea la durabilidad, menores serán los beneficios y más pequeña la inversión que puede justificarse. En biotecnología, la durabilidad va asociada a la exclusividad de los datos”.
De no existir perspectivas fundadas de obtener rentabilidad, los inversores de capital riesgo tendrían escasos motivos para comprometer fondos en un sector en el que los costos y los riesgos son tan elevados, lo cual pondría en peligro la canalización de miles de millones de dólares destinados a financiar el desarrollo de medicamentos punteros.
En 2015, los inversores de capital riesgo de los Estados Unidos destinaron la histórica cifra de 8.950 millones de dólares a empresas emergentes de biotecnología.
La realización de ensayos y la obtención de datos a partir de estos son tareas costosas. Si a ello se le añade la incertidumbre acerca de la patentabilidad de las invenciones biotecnológicas generada por algunas sentencias del Tribunal Supremo de los Estados Unidos en causas como eBay c. MercExchange (2006), Mayo c. Prometheus (2012) y Association for Molecular Pathology c. Myriad (2014), y la dificultad de aplicar los derechos dimanantes de las patentes, se entiende mejor la importancia de la protección de datos de pruebas como medida para garantizar la sostenibilidad de las inversiones en biotecnología médica.
Mercados emergentes
Si bien la protección de datos de pruebas está bien establecida en el Canadá, Europa, el Japón y los Estados Unidos (véase la pág. 39), brilla por su ausencia en muchos países en desarrollo. Uno de estos casos es el de la India, que a pesar de ser un activo participante en la industria farmacéutica mundial y un país donde los inversores nacionales apoyan activamente la protección de datos de pruebas, todavía tiene que avanzar en ese ámbito para ponerse al nivel de los Estados Unidos o del Japón.
Panorama internacional de la protección de datos de pruebas
En los Estados Unidos, el período de protección de datos de pruebas es de 12 años.
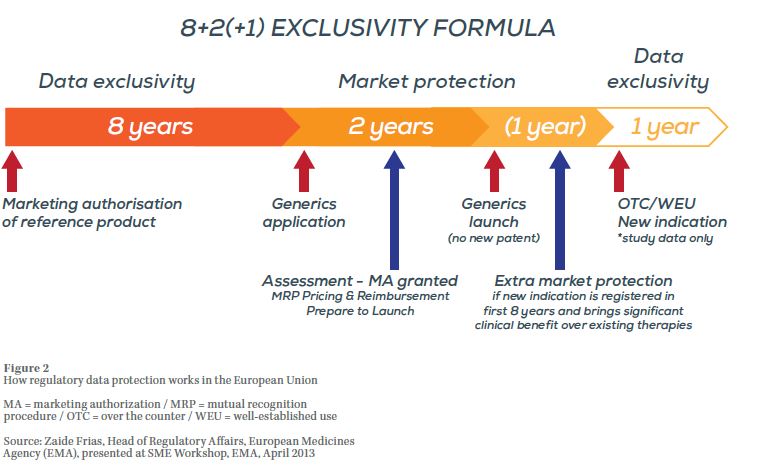
En la Unión Europea, el período de protección es de 11 años en determinadas circunstancias (protección de datos de pruebas durante 8 años, seguidos de 2 años de exclusividad de comercialización y de 1 año adicional de protección de datos de pruebas cuando al titular de los derechos se le concede la autorización de comercializar el producto para una nueva patología). Véase el gráfico 2.
En el Canadá y el Japón, la protección de datos de pruebas para medicamentos biológicos es de 8 años, mientras que en muchas otras jurisdicciones este período oscila entre 5 y 6 años.
En numerosos países en desarrollo no se ha definido claramente un período de protección de datos de pruebas para los medicamentos biológicos.
Anil Joshi, socio directivo de Unicorn Ventures –empresa de capital riesgo con sede en Bombai–, considera que la protección de datos de pruebas tendría repercusiones positivas sobre la inversión en biotecnología en la India: “en biotecnología, los inversores preferirían la exclusividad, pues es importante para proteger la inversión. Me gustaría que existiesen pautas más precisas y claras en cuanto a la protección de la P.I. no solo en el ámbito de la biotecnología, sino en todo tipo de innovación”.
Susan Finston, de Amrita, está de acuerdo: “Es necesario que existan incentivos para la investigación básica. Se precisa un enfoque integral. En ese contexto, la protección de datos de pruebas es muy importante, sobre todo para las empresas pequeñas que no tienen la capacidad financiera para afrontar litigios sobre patentes”.
¿La protección de datos de pruebas dificulta el acceso a los medicamentos?
En un intento de reforzar la protección de los fabricantes de medicamentos biológicos, en abril de 2013 se presentó en el Parlamento de la India el Proyecto de Ley sobre Regulación de la Biotecnología, pero fue rechazado debido a las objeciones de algunos miembros de la Cámara, activistas y grupos de la sociedad civil.
Los críticos de la propuesta alegaron que lo único que se conseguiría con la protección de datos de pruebas sería permitir que la protección de los medicamentos de las grandes empresas farmacéuticas se ampliase más allá de la fecha de expiración de las patentes, lo cual conllevaría un incremento del precio de los medicamentos y dificultaría el acceso a estos.
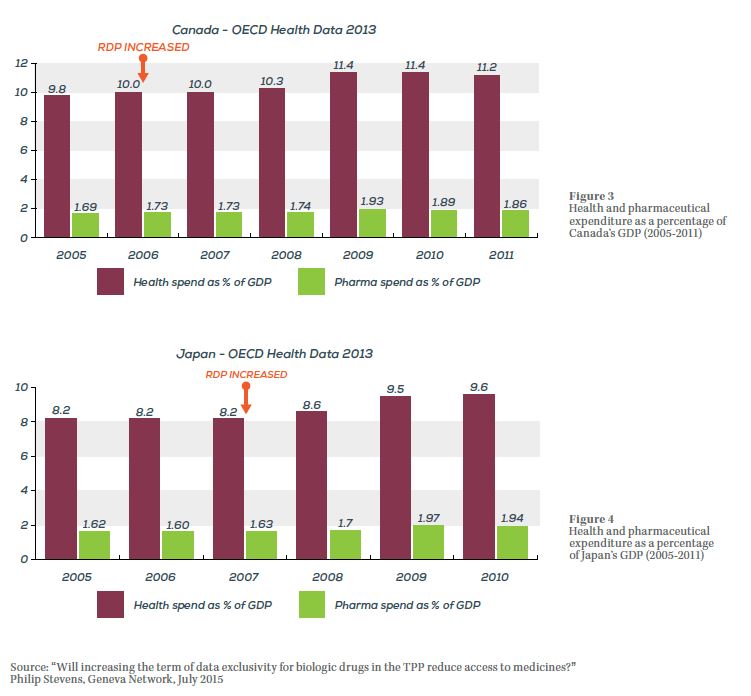
Según investigaciones de Geneva Network, esos temores son infundados. En el Canadá y el Japón se ha ampliado recientemente el período de protección de datos de pruebas sin que se hayan constatado repercusiones sustanciales en la tasa porcentual de gasto del Gobierno en medicamentos respecto al PIB, que permaneció prácticamente inalterada en los años anteriores y posteriores a los cambios (véanse los gráficos 3 y 4).

Los costos de la protección de datos de pruebas deben sopesarse respecto a los beneficios que pueden aportar los nuevos medicamentos. Si bien es cierto que la protección de datos de pruebas protege a los fabricantes de medicamentos biológicos de la competencia de productos biosimilares durante un cierto período de tiempo, también lo es –como señala la Dra. Libecker– que “incentiva la innovación, lo cual da lugar al desarrollo de curas y tratamientos biológicos que, de otra manera, podrían no haber visto la luz. Estos medicamentos benefician a los pacientes, además de mejorar y prolongar vidas. Las consecuencias son individuos más sanos y ahorro para los sistemas de salud”.
Aunque privar a los creadores de medicamentos biológicos de la protección de datos de pruebas puede parecer una opción atractiva a corto plazo y quizás favoreciese una comercialización más rápida de los medicamentos biosimilares, ¿qué consecuencias a largo plazo tendría sobre el desarrollo de medicamentos biológicos?
Jack Lasersohn explica que: “La realidad es que la ley no obliga a los inversores de capital riesgo a apostar por la biotecnología. Podríamos escoger invertir en redes sociales o aplicaciones para teléfonos inteligentes. Sin embargo, como sociedad, probablemente sea más importante financiar el próximo Herceptin que el siguiente WhatsApp”.
Israel: de país de las empresas emergentes a país de la biotecnología
Aunque Israel lleva tiempo siendo alabado como “país de las empresas emergentes”, durante muchos años el país no contó con una base sólida de I+D en biotecnología.
En 2010, el Dr. Eli Opper –científico jefe de Israel– seleccionó la biotecnología como un ámbito de crecimiento prioritario, pero los esfuerzos realizados para crear incubadoras de empresas relacionadas con las ciencias de la vida y un fondo de inversión en biotecnología no consiguieron atraer las inversiones necesarias para que el sector prosperase. Por el contrario, la profunda reforma del sistema de P.I. de Israel, en la que se incluye la introducción de la protección de datos de pruebas para los medicamentos químicos por un período de hasta seis años, sí ha desencadenado una rápida expansión de las inversiones en ciencias de la vida. Entre 2010 y 2014, las inversiones de capital extranjero en el sector aumentaron de 56 millones de dólares EE.UU. a 469 millones, cifra que representó un 59% del total de inversiones en el sector de ciencias de la vida en Israel (801 millones de dólares).
El propósito de OMPI Revista es fomentar los conocimientos del público respecto de la propiedad intelectual y la labor que realiza la OMPI, y no constituye un documento oficial de la Organización. Las denominaciones empleadas en esta publicación y la forma en que aparecen presentados los datos que contiene no entrañan, de parte de la OMPI, juicio alguno sobre la condición jurídica de ninguno de los países, territorios o zonas citados o de sus autoridades, ni respecto de la delimitación de sus fronteras o límites. La presente publicación no refleja el punto de vista de los Estados miembros ni el de la Secretaría de la OMPI. Cualquier mención de empresas o productos concretos no implica en ningún caso que la OMPI los apruebe o recomiende con respecto a otros de naturaleza similar que no se mencionen.