Encourager l’innovation dans le domaine pharmaceutique dans les pays à revenu intermédiaire
Par Tim Wilsdon, vice-président, et Eva Fiz, consultant associé, chez Charles River Associates
Avec chaque nouvel article de presse concernant des nouveaux investissements en Chine ou au Brésil (et la fermeture d’instituts de recherche en Europe), il apparaît de plus en plus comme une évidence que le paysage de la recherche-développement (R-D) dans le domaine pharmaceutique connaît une profonde mutation. Mais les facteurs à l’origine de cette évolution, de même que le rôle que joue la propriété intellectuelle ou encore les incidences sur les politique publiques demeurent des sujets de désaccord qui font débat. Afin de mieux comprendre quels sont les différents facteurs dynamiques qui façonnent l’innovation dans le domaine pharmaceutique, la Fédération internationale de l’industrie du médicament (FIIM) a chargé la société d’experts-conseils en économie Charles River Associates (CRA) de déterminer quelles étaient les conditions propices à l’innovation dans le domaine pharmaceutique et quelles étaient les incidences futures éventuelles en ce qui concerne les politiques en matière d’innovation, notamment dans certains pays à revenu intermédiaire.
Forte de ses entretiens avec des responsables politiques, des entreprises internationales et nationales et des professeurs d’université, la société CRA a analysé l’activité novatrice dans les pays à revenu intermédiaire afin de déterminer dans quelle mesure celle-ci est liée aux politiques appliquées par les pouvoirs publics dans les différents pays étudiés (Brésil, Colombie, Chine, Inde, Malaisie, Afrique du Sud, République de Corée et Fédération de Russie).
Bien que l’on constate une augmentation de l’activité novatrice dans tous les pays étudiés, les possibilités de développer les activités, qui vont de la recherche élémentaire au développement clinique, varient d’un pays à l’autre. Pour que tous les pays disposent des mêmes possibilités, plusieurs éléments sont nécessaires, notamment une politique de santé et une politique industrielle qui soient coordonnées, une politique qui renforce la protection de la propriété intellectuelle et un environnement qui encourage les partenariats entre les différentes parties prenantes.
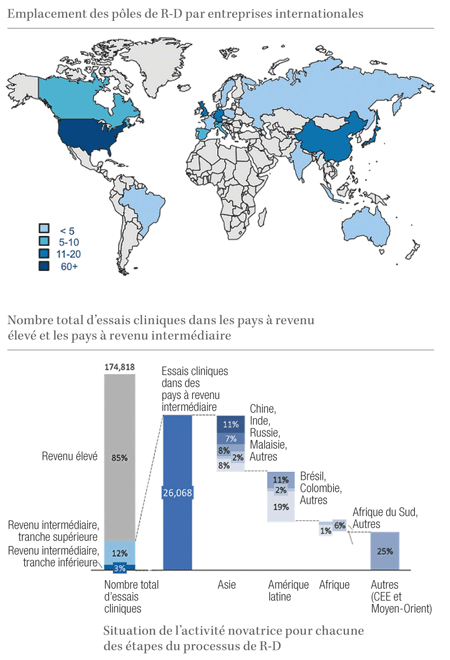
Emplacement des pôles de R-D par entreprises internationales; Nombre total d’essais cliniques
dans les pays à revenu élevé et les pays à revenu intermédiaire Source : Analyse réalisée par CRA.
La carte des pôles de R-D a été réalisée à partir des informations publiées par les membres de
la FIIM en août 2012. Le nombre d’essais cliniques indiqué s’appuie sur les chiffres indiqués sur
le site www.clinicaltrials.gov.
Tendances récentes
Pour bien comprendre quelles sont les tendances récentes et les défis à révéler en termes de politique, il importe de bien faire la différence entre les différents types d’innovations possibles dans le domaine biopharmaceutique. L’activité novatrice est généralement répartie entre la recherche élémentaire (parfois décrite comme la découverte de médicaments), la recherche préclinique et les essais cliniques (également subdivisés en phases I à III (avant la commercialisation) et en phase IV (après la commercialisation)).
Les activités novatrices dans le secteur biopharmaceutique se concentrent principalement dans les pays à revenu élevé; néanmoins, on constate une tendance clairement à la hausse de ces activités dans les pays à revenu intermédiaire. Entre 2005 et 2010, les investissements dans la R-D dans ce secteur ont augmenté de 455% dans la région Asie et Pacifique (à l’exclusion du Japon), de 112% en Amérique latine et de 303% en Inde.
Les premières étapes des travaux de recherche sont réalisées par les entreprises pharmaceutiques internationales qui collaborent étroitement avec les principaux centres de formation universitaire dans des pôles de recherche. Ces pôles de recherche sont principalement concentrés autour de Boston et San Francisco aux États-Unis d’Amérique, Londres et Cambridge (Royaume-Uni), Uppsala (Suède) et Munich (Allemagne) en Europe, et Singapour en Asie. Toutefois, parmi les pays à revenu intermédiaire, la Chine se distingue avec 12 instituts de R-D. L’Inde, le Brésil, la Fédération de Russie et l’Indonésie comptent également quelques pôles de R-D.
Cette tendance à la hausse qui est constatée dans les activités novatrices dans le domaine biopharmaceutique dans les pays à revenu intermédiaire est encore plus marquée si l’on examine les étapes ultérieures du processus de R-D. Par exemple, la recherche clinique est réalisée dans de nombreux pays, dont des pays à revenu intermédiaire qui représentent 15% de l’activité mondiale totale dans le domaine des essais cliniques. La Chine, l’Inde, la Fédération de Russie et le Brésil comptent le plus grand nombre d’essais sur ce marché.
En définitive, le succès des stratégies en matière d’innovation appliquées dans les pays à revenu intermédiaire devrait être mesuré sur la base des résultats obtenus. Bien qu’il soit difficile d’établir un lien entre un médicament mis au point par une entreprise internationale et un marché précis, il existe des exemples d’innovation cumulative dans lesquels les médicaments ont été adaptés aux conditions du marché local dans des pays à revenu intermédiaire. On trouve également un nombre significatif de produits innovants en phases II et III, ainsi qu’un certain nombre de médicaments nouveaux disponibles sur le marché qui ont été mis au point localement dans certains des pays étudiés, tels que la République de Corée, la Chine et l’Inde. Toutefois, aucun médicament vedette ne ressort actuellement des pays étudiés.
Le rôle de la propriété internationale dans le choix de l’emplacement de la R-D
Les facteurs qui déterminent le choix de l’emplacement de l’innovation sont à la fois complexes et difficiles à isoler. Il est clair que pour pouvoir développer l’activité novatrice (notamment les premières étapes de la recherche), les gouvernements doivent disposer d’une politique sur le long terme qui soit en même temps cohérente et mise en œuvre de façon efficace.
Le processus d’innovation dans le domaine biopharmaceutique est long et peut parfois prendre 10 à 12 ans entre la validation du concept et sa commercialisation. Les investissements dans les premières étapes de la recherche ne répondant pas à une logique linéaire, il est difficile d’établir précisément le lien entre le calendrier ou le coût des recherches et les brevets qui en résultent. Il est également difficile de prévoir les délais et les coûts liés à la création de nouveaux centres de recherche, c’est pourquoi il n’est pas surprenant que les décisions concernant le choix de l’emplacement soient compliquées à prendre, car elles revêtent une importance stratégique. À l’avenir, les décisions portant sur de nouveaux investissements seront certainement encore plus difficiles à prendre au vu de la tendance actuelle qui consiste à regrouper les sites de R-D. Néanmoins, comme indiqué plus haut, même si la grande majorité des sites internationaux de R-D demeurent aux États-Unis d’Amérique et en Europe, on constate que le Chine, en tant que pôle de R-D, a acquis une importance considérable.
Ce succès vient en partie du fait que la Chine s’engage depuis longtemps à promouvoir l’innovation dans le secteur pharmaceutique, un engagement qui est considéré comme un indicateur important d’un environnement futur propice à l’innovation en Chine. La Chine applique depuis 2006 des politiques cohérentes à la fois dans les secteurs public et privé pour encourager l’innovation dans le domaine pharmaceutique.
Les conditions nécessaires au renforcement des capacités d’innovation varient selon qu’il s’agit des premières étapes de la recherche ou d’étapes ultérieures de développement. Les premières étapes de la recherche et les recherches précliniques nécessitent les meilleures compétences issues des milieux universitaires et de la recherche. Toutes les entreprises consultées s’accordent à dire que la disponibilité de “compétences” est le principal critère justifiant le choix de l’emplacement des infrastructures destinées aux premières étapes de la recherche. Bien que l’on puisse engager des personnes compétentes sur place, une institution ou un groupe de recherche de renommée mondiale est considéré comme un élément essentiel pour développer cette capacité. En outre, pour réussir, les milieux universitaires doivent créer une culture de collaboration avec les entreprises privées qui seraient inévitablement impliquées dans la mise au point des médicaments. Mais il faut du temps pour mettre en place ce type de culture qui fait défaut dans la majorité des pays étudiés.
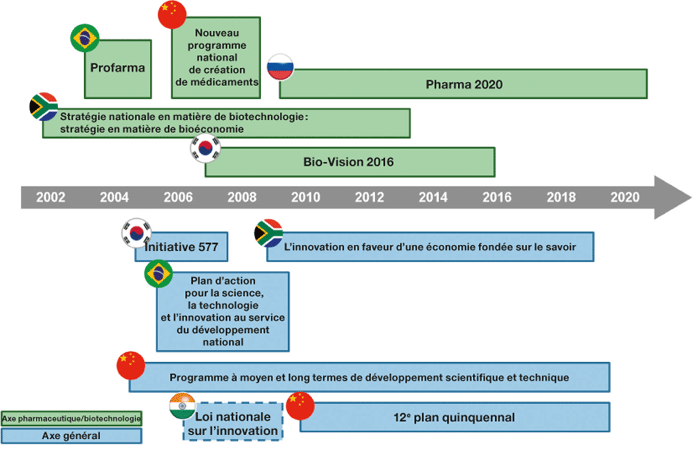
Source : Analyse réalisée par CRA. *Le programme d’innovation nationale indien
date de 2008 mais n’a pas encore été mis en œuvre. Le nouveau programme d’innovation
actuellement en phase d’élaboration, dit Politique d’innovation scientifique et technologique,
devrait être annoncé en 2013. **Des modifications du programme ont été proposées en
raison de difficultés budgétaires.
Les essais cliniques reposent sur des compétences et une expérience considérables dans la gestion et la supervision des essais, conformément aux normes internationales. L’intérêt dans la réalisation de ces essais augmente de manière significative lorsqu’un produit est destiné au marché local, les données locales et les données cliniques étant indispensables à cette fin. Certains pays ne possèdent pas un marché ou une population suffisante pour encourager les essais cliniques à grande échelle. Une politique coordonnée, cohérente, ciblée et progressive est donc nécessaire afin de renforcer les capacités de réaliser sur une grande échelle les essais requis pour le stade avancé de développement clinique.
Le modèle d’innovation qui prévaut dépend des brevets comme point de départ pour assurer un retour sur investissement pour toutes les personnes qui investissent de différentes manières à diverses étapes du processus d’innovation. C’est pourquoi les décisions concernant le choix de l’emplacement des installations de recherche élémentaire et préclinique dépendent dans une large mesure du régime de propriété intellectuelle dont dispose le pays. Les entreprises internationales et nationales investissent dans un processus de recherche risqué uniquement s’il est possible de protéger la propriété intellectuelle associée à leurs investissements. Dans les entrevues réalisées, les responsables politiques ont indiqué que la confiance en leur régime de propriété intellectuelle était essentielle et que des règles de propriété intellectuelle robustes pouvaient représenter un véritable avantage concurrentiel en ce qu’elles encourageaient l’activité novatrice à l’échelle nationale. L’étude a démontré que les entreprises nationales investissent dans la recherche uniquement aux emplacements où la protection de la propriété intellectuelle est suffisante. C’est l’une des raisons pour lesquelles la Chine a réussi plus que les autres pays à attirer des investissements dans la recherche. Pour les innovateurs nationaux dans le domaine pharmaceutique, qui dépendent fortement du marché local, la propriété intellectuelle est d’autant plus importante.
Dans une moindre mesure, les décisions concernant le choix de l’emplacement des essais cliniques dépendent de la protection disponible durant les essais. Dans l’ensemble, la protection de la propriété intellectuelle joue un rôle dans le choix des sites des essais cliniques puisque, toutes choses égales par ailleurs, les entreprises préfèrent réaliser des essais dans des pays où les droits conférés par les brevets sont respectés. Les entrevues ont révélé que si l’objectif est de développer un secteur biopharmaceutique innovant (soit en encourageant les entreprises locales, soit en attirant des investissements d’entreprises internationales), la propriété intellectuelle est nécessaire (bien que pas suffisante).
Les partenariats sont essentiels dans les premières étapes de la recherche
Les études réalisées indiquent également que, dès lors que l’infrastructure de base est créée, les investissements publics dans la R-D ne suffisent pas à assurer le développement d’un secteur qui soit durable en termes d’innovation. Les partenariats sont indispensables pour soutenir les premières étapes de la recherche. Pour la recherche clinique, les partenariats semblent se créer avec une participation moindre des pouvoirs publics. Les forces du marché, notamment, semblent être principalement à l’origine de l’apparition d’organisations de recherche clinique (ORC) à l’échelle nationale et de leur succès pour ce qui est d’attirer les essais cliniques.
L’industrie pharmaceutique mondiale a joué un rôle important dans la promotion de l’innovation dans les marchés émergents au cours des 10 dernières années. Cela vient en partie de la croissance plus lente au cœur de l’activité sur les marchés occidentaux. Le secteur a adopté une approche forte et positive dans son engagement auprès des marchés à revenu intermédiaire (notamment la Chine). Il a non seulement investi dans les filiales locales de distribution, mais également créé des partenariats avec les milieux universitaires et de la recherche et, dans certains cas, avec des centres de recherche indépendants de renom.
Résumé des conclusions
- Les politiques appliquées doivent être adaptées aux dimensions du marché et à la population de chaque pays;
- renforcer les capacités au fil du temps dans les domaines dans lesquels un pays peut être compétitif à l’échelle internationale prend du temps, nécessite des investissements considérables et passe par l’élaboration et l’application progressive de programmes ciblés;
- favoriser l’innovation dans le pipeline de développement de médicaments, de la recherche fondamentale au développement clinique, nécessite une série de politiques, y compris un cadre politique cohérent, une politique de santé et une politique industrielle qui soient coordonnées, une politique qui renforce la protection de la propriété intellectuelle et un environnement qui encourage les partenariats entre les différentes parties prenantes.
Approfondir la recherche
Bien qu’il existe une vaste littérature sur ce qui détermine l’innovation et la politique d’innovation en général, des lacunes considérables subsistent. Par exemple, des études complémentaires sont nécessaires pour mieux comprendre quels sont les facteurs qui déterminent les différents types d’investissements directs étrangers et la façon dont ceux-ci sont liés à un régime de propriété intellectuelle particulier.
Le Magazine de l’OMPI vise à faciliter la compréhension de la propriété intellectuelle et de l’action de l’OMPI parmi le grand public et n’est pas un document officiel de l’OMPI. Les désignations employées et la présentation des données qui figurent dans cette publication n’impliquent de la part de l’OMPI aucune prise de position quant au statut juridique des pays, territoires ou zones concernés ou de leurs autorités, ni quant au tracé de leurs frontières ou limites territoriales. Les opinions exprimées dans cette publication ne reflètent pas nécessairement celles des États membres ou du Secrétariat de l’OMPI. La mention d’entreprises particulières ou de produits de certains fabricants n’implique pas que l’OMPI les approuve ou les recommande de préférence à d’autres entreprises ou produits analogues qui ne sont pas mentionnés.