
Pat-INFORMED: una nueva herramienta para la adquisición de medicamentos
Por Mark F. Schultz, profesor de la Facultad de Derecho de la Universidad de Southern Illinois, y Jaci Arthur, directora de Investigación del Instituto para la Investigación de la Propiedad Intelectual, Illinois (Estados Unidos)
Desarrollar un medicamento es un proceso muy complejo que implica muchas medidas innovadoras, muchas de las cuales pueden protegerse con patentes. Aunque tragarse una pequeña pastilla pueda parecer sencillo y mucho menos complicado que, por ejemplo, utilizar nuestro teléfono inteligente, lo cierto es que hay un elevado grado de tecnología y conocimientos especializados detrás de todos los medicamentos que utilizamos. Se invierte una enorme cantidad de ciencia e investigación no solo en el descubrimiento de componentes activos para tratar una enfermedad, sino también para calcular la dosis adecuada y el momento óptimo de liberación, es decir el tiempo que el medicamento permanece activo en nuestro cuerpo.

Poner a punto un medicamento es una tarea que lleva muchos años y, en el transcurso de su puesta a punto, los investigadores se pueden encontrar con que las moléculas con las que están trabajando tienen nuevas propiedades, atributos y aplicaciones que también pueden ser patentables. Esto significa que cualquier medicamento o fármaco puede estar vinculado a muchas patentes. Diferenciar entre patentes clave relacionadas con la formulación específica de un medicamento y patentes más periféricas relacionadas con aplicaciones muy concretas puede ser difícil, especialmente para quien no es un especialista en patentes, como por ejemplo alguien que adquiere fármacos para un organismo de ayuda.
El desafío
El desafío de buscar patentes de medicamentos se complica por el hecho de que no es probable que ni el nombre genérico ni la marca de los medicamentos aparezcan en las patentes. Lo más probable es que la solicitud de patente del medicamento se presente y se conceda en las etapas iniciales del desarrollo del producto, mucho antes de que el ingrediente activo de la fórmula reciba un nombre genérico (es decir, una denominación común internacional (DCI)) o una marca registrada. La discrepancia inevitable entre la terminología empleada para describir un medicamento en una patente y el nombre por el que el producto suele ser reconocido puede suscitar problemas a la hora de evaluar la situación de la patente de un medicamento.

específicos es difícil a causa de la discrepancia en la terminología
utilizada para describir un medicamento en una patente y el nombre
por el que se conoce normalmente el producto (foto: alvarez
/ E + / Getty Images).
Algunos países han logrado superar este desfase en la información publicando bases de datos, como el “Libro Naranja” de los Estados Unidos, que enumera las patentes correspondientes a cada medicamento según el nombre normalizado de cada uno de ellos. El Libro Naranja también indica el momento en que expiran las patentes y otros derechos exclusivos. Sin embargo, el Libro Naranja solo ofrece información sobre los Estados Unidos, y la mayoría de los países no proporcionan referencias tan claras y sencillas.
Conocer la situación de las patentes de medicamentos es más fácil con Pat-INFORMED
La Organización Mundial de la Propiedad Intelectual (OMPI) y la Federación Internacional de Asociaciones de Industriales Farmacéuticos (IFPMA), junto con 20 empresas farmacéuticas a nivel mundial, se han aliado para superar este desfase en la información globalizando en la práctica el concepto del Libro Naranja.
En el marco de la iniciativa relativa a la información sobre medicamentos patentados (Pat-INFORMED), que se puso en marcha en septiembre de 2018, la OMPI, la IFPMA y sus socios están facilitando información – concretamente números de patentes y fechas de presentación de las solicitudes y de concesión de las patentes– sobre medicamentos autorizados en jurisdicciones de todo el mundo.
Pat-INFORMED relaciona la información contenida en las patentes a nivel mundial con los nombres de producto de medicamentos importantes. La base de datos ofrece una interfaz clara y fácil de usar, en la que al introducir la DCI de un producto se genera una lista concisa de patentes, que incluye el nombre de la empresa propietaria de las patentes y los países en los que han sido concedidas.
Disponer de esta información en un solo sitio es un gran salto adelante para todos aquellos interesados en las patentes de productos farmacéuticos. El objetivo principal del proyecto es ayudar a los organismos encargados de las adquisiciones a obtener información sobre la situación de la patente de un medicamento concreto en una determinada jurisdicción. Pat-INFORMED complementará otros recursos en materia de bases de datos de patentes, como los gestionados por entidades comerciales, oficinas nacionales de patentes y la propia PATENTSCOPE de la OMPI, que actualmente alberga aproximadamente 71 millones de documentos de patentes.
¿Por qué resulta difícil encontrar las patentes de medicamentos?
Es probable que la mayoría de los medicamentos tengan por lo menos dos nombres: una denominación de marca elegida por el innovador y una DCI (normalmente conocida como nombre genérico), que identifica las sustancias farmacéuticas o los ingredientes farmacéuticos activos. Las DCI se registran en la Organización Mundial de la Salud (OMS). Por ejemplo la DCI del conocido medicamento contra la hepatitis C que lleva por nombre Solvadi, es sofosbuvir. Del mismo modo, el analgésico sin receta conocido popularmente por su DCI, ibuprofeno, también se conoce por las marcas Advil, Motrin, Bufren, Nurofen y muchas otras.
Las DCI desempeñan una función importante en la salud pública al crear una denominación compartida para los medicamentos que traspasa fronteras nacionales, marcas y especialidades sanitarias, simplificando la comunicación y evitando la confusión. Este lenguaje compartido garantiza que todo el mundo comprenda fácil y sistemáticamente las descripciones de los medicamentos en las recetas, los historiales médicos, las órdenes de compra, los inventarios y otras comunicaciones.
Los médicos, los profesionales de la salud, los farmacéuticos y los especialistas que se dedican a la adquisición de medicamentos utilizan las DCI como un lenguaje común (incluso cuando se refieren también a las marcas). En esencia, las DCI abarcan el formulario mundial de medicamentos conocidos. En la OMS hay más de 8.000 DCI registradas.
Desafortunadamente, el lenguaje común creado por las DCI no se traslada al lenguaje empleado para las patentes relacionas con los medicamentos. Con frecuencia, las patentes de productos farmacéuticos no hacen referencia a las DCI. Estas patentes suelen describir un medicamento por su composición química o por un nombre ampliamente aceptado por los expertos en el ámbito correspondiente, pero que difiere de la DCI.
La ausencia de DCI en los documentos de patente no es una omisión deliberada. Es consecuencia del proceso de desarrollo de los medicamentos, en el que ambos elementos surgen en distintos momentos. Es muy posible que una solicitud de patente sea aprobada años antes de que se presente una solicitud de DCI.
Este desfase entre la concesión de patentes y DCI es el resultado lógico del modo en que se desarrolla el proceso de descubrimiento de los medicamentos. Las patentes protegen los primeros avances en el desarrollo de los medicamentos. Son la antesala, y quizá la condición, para seguir financiando las pruebas y el desarrollo de los medicamentos. Las DCI se asignan cuando los avances se han consolidado.
En el momento en que una compañía farmacéutica presenta una solicitud de DCI ante la OMS, ya se habrán presentado – y quizá concedido - algunas patentes conexas, y es probable que estén a punto de comenzar los ensayos clínicos del medicamento. Tras la presentación de la solicitud para obtener una DCI, la espera promedio para la publicación de una “DCI recomendada” es de 15 meses, tras lo cual se abre un periodo de cuatro meses para formular objeciones a esa denominación.
La ineludible ausencia de DCI en muchas patentes de productos farmacéuticos importantes significa que no comparten el lenguaje que utiliza el resto de la comunidad sanitaria para identificar los medicamentos. Por lo tanto, es improbable que sea posible reconocer las correspondientes solicitudes de patentes que se presentaron con anterioridad a la fecha de concesión de la DCI mediante una búsqueda en la que se utilice el nombre genérico común. Esto puede confundir a quienes quieren conocer la situación de la patente de un medicamento. Los investigadores sin experiencia pueden sacar conclusiones erróneas de resultados incompletos, mientras que los más experimentados pueden albergar la duda de que han dejado pasar algo por alto debido a la ausencia de una terminología común.
El problema es especialmente grave para las personas que no son expertas en patentes y trabajan en el sistema sanitario, que dependen de las DCI para identificar los medicamentos patentados. La mayoría de los organismos encargados de las adquisiciones contratan a especialistas que conocen mucho mejor las DCI que los compuestos químicos, los nombres químicos o las clasificaciones de patentes utilizadas para efectuar búsquedas en la mayoría de las bases de datos de patentes. Estas dificultades se presentan en todo el sistema sanitario. Ministerios, investigadores, grupos de ayuda y otros suelen tener dificultades para determinar la situación de las patentes de los medicamentos en distintos países cuando realizan una búsqueda a partir del nombre genérico.
La satisfacción de una necesidad de larga data
Las dificultades relacionadas con la búsqueda de patentes a partir de las DCI han llevado a muchos observadores a considerar planteamientos alternativos. Por ejemplo, la OMS ha señalado sistemáticamente las dificultades relacionadas con este desfase en el lenguaje y ha recomendado diversas estrategias para solucionar el problema. El Comité Permanente sobre el Derecho de Patentes de la OMPI también ha estudiado varias opciones. La India consideró la imposición – declinada en última instancia – de un requisito de divulgación de las DCI en las solicitudes de patente. Asimismo, en 2016, una gran coalición ad hoc de grupos de la sociedad civil pidió más información para vincular patentes de medicamentos y DCI.
Pat-INFORMED satisface esta necesidad que viene de lejos. Por primera vez, con un par de clics los usuarios pueden encontrar información sobre todas las patentes relacionadas con una DCI.
Veinte empresas líderes del sector farmacéutico se han comprometido a hacer aportaciones a la base de datos, que contiene información sobre los fármacos de la Lista de Medicamentos Esenciales de la OMS, así como de importantes especialidades terapéuticas como la oncología, la hepatitis C, las enfermedades cardiovasculares, el VIH, la diabetes y las enfermedades respiratorias. El proyecto persigue cubrir en el futuro todas las especialidades terapéuticas y estudiará la viabilidad de incluir otros tratamientos, terapias complejas y vacunas.
La participación en Pat-INFORMED es voluntaria. Sus participantes se comprometen a divulgar patentes esenciales en los países en los que se conceden, con información detallada sobre todas las terapias incluidas. Esta información se actualizará cada seis meses para los productos que forman parte de la Lista de Medicamentos Esenciales y anualmente para el resto.
Este compromiso, sumado al carácter exhaustivo de la base de datos, significa que quienes estudian la situación de las patentes de los medicamentos disponen ahora de acceso a una fuente fiable que facilitará el contacto con los titulares de las patentes. Este es uno de los objetivos principales de la iniciativa.
La adquisición de medicamentos a cargo de Ministerios de Sanidad, fabricantes, donantes y organismos de ayuda puede ser compleja y costosa. Las malas prácticas en la adquisición de medicamentos pueden provocar incluso escasez de medicamentos de alta calidad que salvan vidas. Por esta razón, son fundamentales las nuevas herramientas que facilitan y mejoran este proceso, como Pat‑INFORMED.
Compañías participantes en Pat-INFORMED
-
AbbVie (Estados Unidos de América)
-
Astellas Pharma Inc. (Japón)
-
Bristol-Myers Squibb (Estados Unidos de América)
-
Daiichi-Sankyo (Japón)
-
Eisai (Japón)
-
Gilead Sciences, Inc. (Estados Unidos de América)
-
GlaxoSmithKline (GSK) (Reino Unido)
-
IPSEN (Francia)
-
Johnson & Johnson (Estados Unidos de América)
-
Leo Pharma (Dinamarca)
-
Lilly (Estados Unidos de América)
-
Merck KGaA (Alemania)
-
MSD (aka Merck & Co., Inc.) (Estados Unidos de América)
-
Novartis (Suiza)
-
Novo Nordisk (Dinamarca)
-
Pfizer (Estados Unidos de América)
-
Roche (Suiza)
-
Shionogi Inc. (Japón)
-
Takeda (Japón)
-
UCB (Bélgica)
Pat-INFORMED permitirá finalmente acabar con la discrepancia terminológica entre las DCI y la información contenida en las patentes. Y lo más importante, la base de datos es gratuita, está a disposición del público y es fácil de usar. Incluso quienes no son especialistas pueden obtener mejores resultados, y con mayor rapidez, que antes.
Una herramienta completa, precisa y fácil de usar
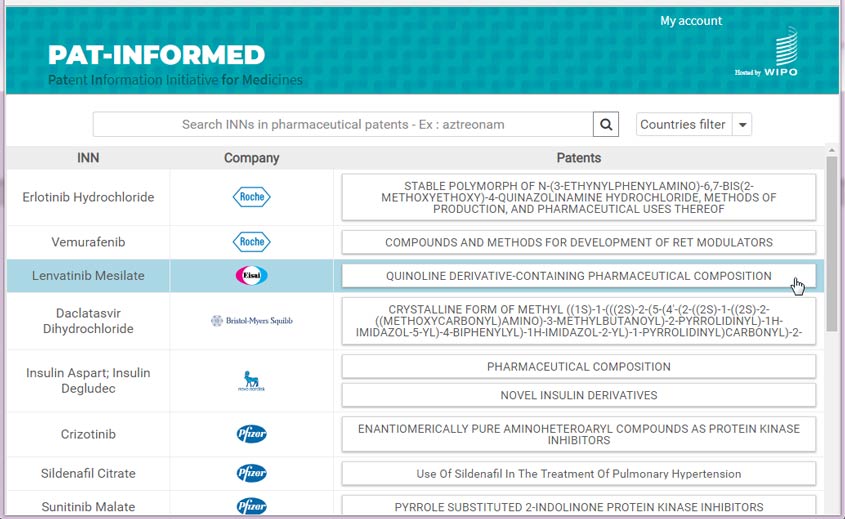
Pat-INFORMED abre nuevas perspectivas en lo que se refiere a su precisión y cobertura global, así como sobre el modo de fusionar y relacionar la información pertinente a través de una interfaz clara e intuitiva. Cuando acceden a la base de datos, los usuarios simplemente tienen que introducir la DCI o nombre genérico del medicamento sobre cuya patente quieren obtener información. Los resultados muestran todos las DCI relevantes, con otros grupos o familias enumerados a la derecha de cada uno de ellos – En Pat-INFORMED estos grupos se llaman “cards” (“tarjetas”). Haciendo clic en una tarjeta, el usuario puede acceder a información clave sobre la patente correspondiente, a un enlace para ponerse en contacto con la compañía titular de esa patente y a un recuadro específico para cada jurisdicción en la que se ha concedido la patente. Cada uno de estos recuadros ofrece información sobre la patente, como su número de publicación, la fecha de publicación, la fecha de concesión, el número de la concesión y, si estuviera disponible, un enlace con el texto de la patente en la base de datos PATENTSCOPE de la OMPI (ver Figura 1).
Una herramienta fundamental para el mercado farmacéutico mundial
Más allá de alojar Pat-INFORMED, la OMPI y la IFPMA actuarán como intermediarios para garantizar que todas las solicitudes de buena fe procedentes de los organismos encargados de las adquisiciones se reenvían a las compañías farmacéuticas correspondientes.
Resulta crucial que todos los titulares de patentes participantes se hayan comprometido a responder a estas solicitudes. Ahora, gracias a Pat-INFORMED, cualquier persona que participa en la adquisición de medicamentos y que busca información sobre la situación de las patentes puede dar con la persona de contacto adecuada de una compañía farmacéutica participante y tener la garantía de que recibirá una respuesta. Esto convierte a Pat-INFORMED en una herramienta indispensable para el mercado farmacéutico mundial.
Pat-INFORMED contribuirá a superar las discrepancias entre las DCI y la información contenida en las patentes. Aunque la base de datos no es la única fuente de información para la toma de decisiones sobre adquisición de medicamentos, facilitará el proceso de identificación de los medicamentos que salvan vidas necesarios para los pacientes, y contribuirá a que funcione con mayor fluidez el proceso de adquisición de medicamentos. La base de datos de Pat-INFORMED ya representa un avance importante y fundamental para el mercado de medicamentos patentados. Augura beneficios adicionales en términos de cimentar procesos más eficaces de adquisición de medicamentos, habida cuenta de que incluye otras áreas de producto y que más compañías se están sumando a la iniciativa.
El propósito de OMPI Revista es fomentar los conocimientos del público respecto de la propiedad intelectual y la labor que realiza la OMPI, y no constituye un documento oficial de la Organización. Las denominaciones empleadas en esta publicación y la forma en que aparecen presentados los datos que contiene no entrañan, de parte de la OMPI, juicio alguno sobre la condición jurídica de ninguno de los países, territorios o zonas citados o de sus autoridades, ni respecto de la delimitación de sus fronteras o límites. La presente publicación no refleja el punto de vista de los Estados miembros ni el de la Secretaría de la OMPI. Cualquier mención de empresas o productos concretos no implica en ningún caso que la OMPI los apruebe o recomiende con respecto a otros de naturaleza similar que no se mencionen.